歐亞經(jīng)濟(jì)聯(lián)盟(EAEU)是一個(gè)由俄羅斯、白俄羅斯、哈薩克斯坦、亞美尼亞和吉爾吉斯斯坦組成的區(qū)域性經(jīng)濟(jì)組織。其醫(yī)療器械注冊(cè)制度基于EAEU《醫(yī)療器械流通統(tǒng)一原則協(xié)定》(2018年生效)及附屬技術(shù)法規(guī),旨在統(tǒng)一聯(lián)盟內(nèi)醫(yī)療器械的市場(chǎng)準(zhǔn)入標(biāo)準(zhǔn),確保產(chǎn)品的安全性、有效性和質(zhì)量。
一、法律框架與核心法規(guī)
EAEU醫(yī)療器械注冊(cè)的法律基礎(chǔ)主要包括:
- 《歐亞經(jīng)濟(jì)聯(lián)盟條約》及理事會(huì)決議;
- 《醫(yī)療器械流通統(tǒng)一原則協(xié)定》(2021年全面實(shí)施);
- 歐亞經(jīng)濟(jì)委員會(huì)(EEC)制定的技術(shù)法規(guī),如對(duì)醫(yī)療器械分類、注冊(cè)程序、技術(shù)文件、臨床評(píng)估和上市后監(jiān)督的具體要求。
二、注冊(cè)流程概述
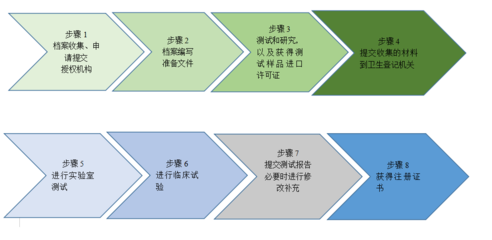
注冊(cè)流程由EAEU統(tǒng)一管理,申請(qǐng)者需向任一成員國(guó)的主管機(jī)構(gòu)(如俄羅斯的Roszdravnadzor)提交申請(qǐng),通過(guò)后注冊(cè)證書在整個(gè)聯(lián)盟內(nèi)有效。主要步驟包括:
- 分類確定:根據(jù)風(fēng)險(xiǎn)等級(jí)(I、IIa、IIb、III類)劃分醫(yī)療器械;
- 技術(shù)文件準(zhǔn)備:包括產(chǎn)品描述、技術(shù)規(guī)格、風(fēng)險(xiǎn)管理文件、臨床評(píng)估報(bào)告和標(biāo)簽信息;
- 測(cè)試與評(píng)估:可能需要在認(rèn)可實(shí)驗(yàn)室進(jìn)行性能和安全測(cè)試;
- 專家評(píng)審:由主管機(jī)構(gòu)或指定機(jī)構(gòu)進(jìn)行文件審查和現(xiàn)場(chǎng)審核;
- 證書簽發(fā):注冊(cè)有效期為5-10年,可續(xù)期。
三、關(guān)鍵法律要求
- 符合性評(píng)估:必須符合EAEU統(tǒng)一技術(shù)法規(guī),包括安全性和有效性標(biāo)準(zhǔn);
- 本地代表:非EAEU制造商需指定聯(lián)盟內(nèi)的授權(quán)代表;
- 標(biāo)簽與語(yǔ)言:產(chǎn)品標(biāo)簽和使用說(shuō)明需使用俄語(yǔ)及成員國(guó)語(yǔ)言;
- 上市后監(jiān)督:包括不良事件報(bào)告、定期安全更新和市場(chǎng)監(jiān)管。
四、挑戰(zhàn)與建議
EAEU注冊(cè)制度雖簡(jiǎn)化了多國(guó)市場(chǎng)準(zhǔn)入,但法規(guī)更新頻繁,且各國(guó)實(shí)施細(xì)節(jié)可能略有差異。企業(yè)應(yīng)及早規(guī)劃,與本地專家合作,確保合規(guī)。總體而言,該制度促進(jìn)了歐亞區(qū)域醫(yī)療器械貿(mào)易的規(guī)范化,為全球制造商提供了重要市場(chǎng)機(jī)會(huì)。